
新聞中心

第一作者:朱俊 張碩卿
通訊作者:李浩然
文章名稱:《Noninnocent Spectator Ligands Facilitate CO Ligand-Stabilized Mn(I) Metal-Catalyzed Hydrogenation of Urea Derivatives or Carbamates to the More Reactive Formamides》
影響因子:13.1
01老師簡介
李浩然老師是浙江大學化學系求是特聘教授。主要從事綠色化學研究(包括空氣氧化反應和選擇性催化加氫反應的工藝、機理、動力學及其催化劑、反應器設計以及離子液體基礎及應用研究);長期致力于我國維生素及相關產業的綠色工藝研究與開發,先后完成了脂溶性維生素、色素及其芳樟醇類與檸檬醛類系列香料等大型產業化項目;相關成果獲國家技術發明獎二等獎等。
02論文研究背景
近幾十年來,在酮類和醛類以及酯類和酰胺類等具有挑戰性的底物的加氫方面取得了重大進展。然而,羰基化合物在催化加氫反應中的反應性強烈依賴于羰基的親電性,并遵循甲酸酯> 甲酰胺類化合物 > 碳酸鹽 > 氨基甲酸酯 > 脲類的反應順序。由于氨基甲酸酯和尿素衍生物中的羰基親電性低,它們的加氫反應和對羰基的親核進攻反應較弱,所以研究相對較少。自從Milstein團隊在2011年報道了Ru催化尿素衍生物加氫得到胺和甲醇的開創性工作以來,尿素衍生物或氨基甲酸酯的加氫逐漸受到研究人員的關注。由于氨基甲酸酯或尿素衍生物比甲酰胺類化合物的加氫反應性更差,因此很難在這些加氫制甲醇的催化體系中富集甲酰胺類化合物。此外,氨基甲酸酯選擇性加氫制甲酰胺類化合物比尿素衍生物更難控制,因為該過程涉及到C?N(加氫脫氨)和C?O(加氫脫醇)鍵的選擇性斷裂。總的來說,氨基甲酸酯或尿素衍生物選擇性加氫生成反應性更強的甲酰胺類化合物,而不損失源自于CO2的羰基部分是非常有意義的,也是挑戰性的。
03論文亮點/摘要
目前尿素衍生物或氨基甲酸酯(兩種具有挑戰性的羰基化合物)選擇性加氫制反應性更強的甲酰胺類化合物的研究主要集中在Ru或Ir基貴金屬催化劑體系,而Mn基豐產金屬催化劑的催化活性和選擇性仍不理想。催化劑的催化活性和選擇性在很大程度上取決于金屬的性質以及合適的配體。因此,在氨基甲酸酯或尿素衍生物的半加氫反應中,仍然有機會設計合適的配體并增強Mn?H配合物的反應活性,表現出更優異的催化活性和選擇性以及底物適用范圍。因此,我們從調節配體的角度出發,采用實驗和密度泛函理論(DFT)計算相結合的方式,設計了一種高效催化氨基甲酸酯或尿素衍生物半加氫的Mn基催化劑體系。
04圖文解析
對于Mn基體系,穩定Mn(I)金屬中心的CO配體通常在與三齒配體絡合后被保留。由于CO是強配體,取代它比較困難,從而配位飽和的Mn?H配合物限制了底物與金屬中心的配位,抑制了這些羰基化合物的加氫。計算研究表明:該步驟需要明顯更高的吸熱能,吉布斯自由能變化為57.4 kcal/mol,比Ru基催化劑高32.5 kcal/mol。我們引入參與反應的配體來促進加氫反應,它能使兩個氫原子同時從一個H2分子轉移,或許可以避免傳統配體體系要求很高的H2配位步驟。

為了探索有效的催化劑體系,本研究對配體進行了篩選。在KOtBu助劑存在下,最初利用Mn(CO)5Br結合triphos配體(1)進行加氫實驗,1,3?雙(4?

為了探究尿素衍生物或氨基甲酸酯選擇性加氫反應的機理,本研究進行了系列對照實驗和氘代標記實驗。實驗結果證明Mn?H配合物A為催化活性物質,吡啶基PNP參與反應配體和CO配體穩定的錳(I)金屬中心通過金屬-配體協同作用催化尿素衍生物或氨基甲酸酯選擇性半加氫生成甲酰胺類化合物。
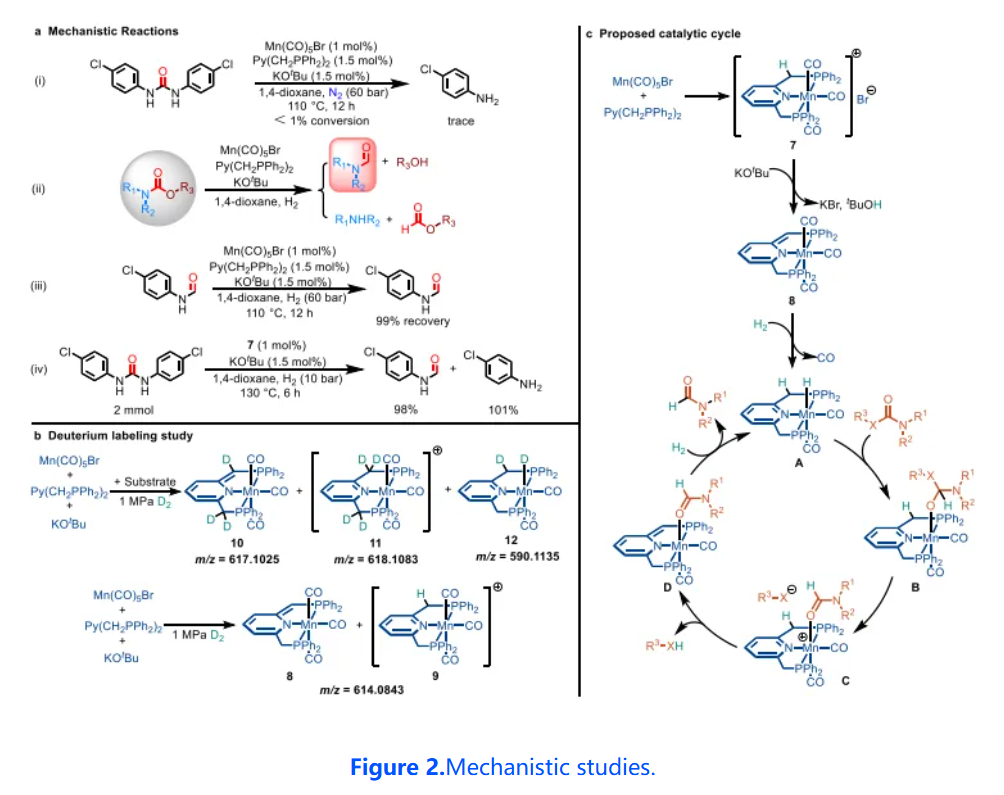
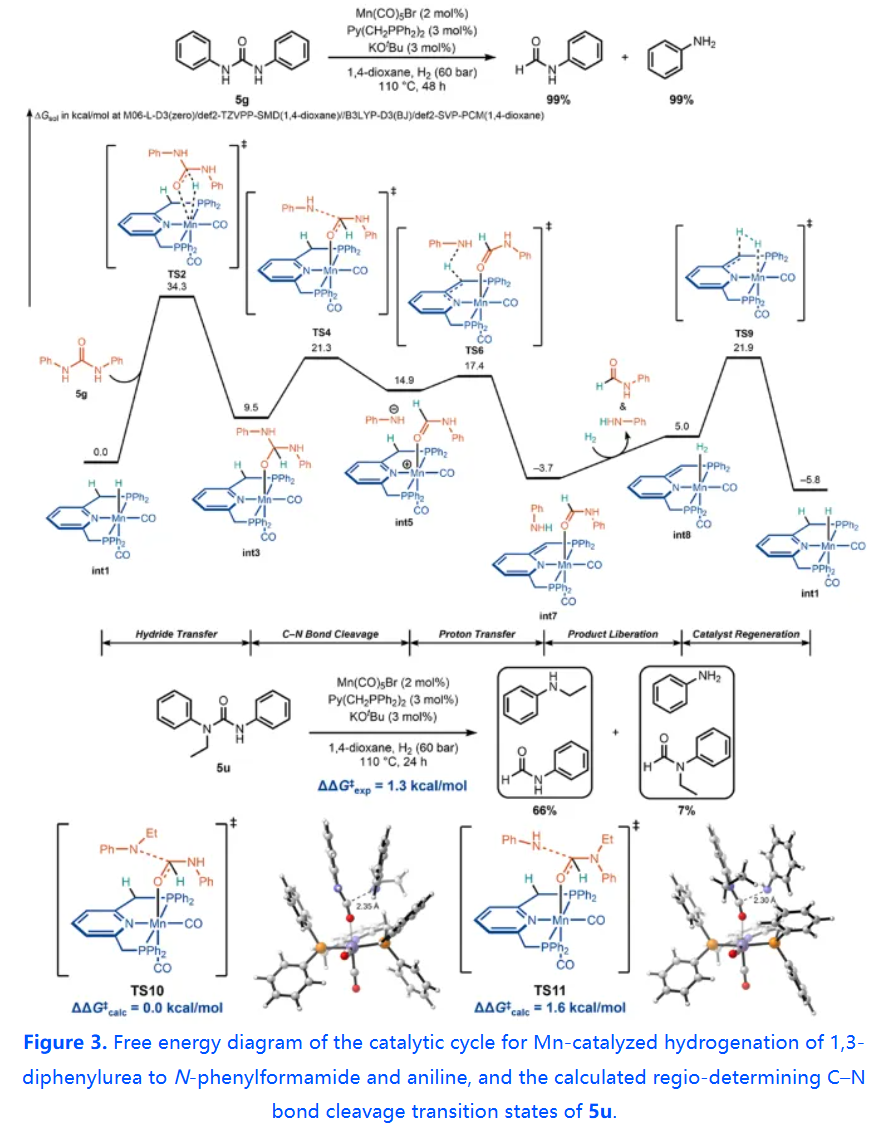
隨后,利用DFT計算研究了尿素衍生物或氨基甲酸酯中羰基加氫和C–N鍵斷裂的反應途徑。并且基于實驗和DFT計算研究,提出了一個合理的催化循環。
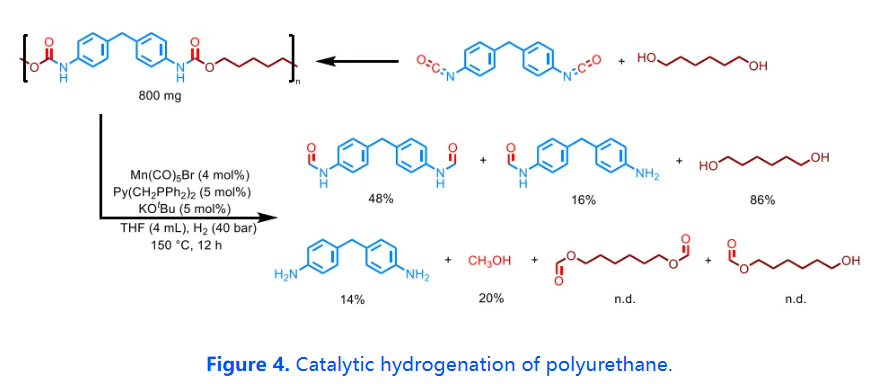
此外,近年來,為了減少化石燃料的消耗,實現可持續發展,解聚回收塑料廢物等新的化工原料已被認為是一個緊迫的社會問題。由于聚氨酯具有與氨基甲酸酯相似的羰基官能團結構,這促使本研究進一步探究了該催化劑體系在聚氨酯化學回收領域的應用。
05本文所用設備
李浩然老師課題組在實驗中所用磁力攪拌反應釜由科冪儀器提供,論文中也特別提到安徽科冪儀器有限公司,在此非常感謝老師對科冪儀器的選擇和認可。

 關注微信
關注微信